Interactions entre cellules vivantes et champs électromagnétiques: preuves expérimentales des effets de ces champs sur la transduction des signaux et sur la prolifération cellulaire
Résumé d’un article de Robert P. LIBURDY(*) (ex : « On the Nature of Electromagnetic Field Interaction with Biological systems. » Ed. R.G. Landes Cy., 1994).
(*) Lawrence Berkeley Laboratory, University of California Berkeley, California, U.S.A.
Introduction et vue d’ensemble
Les recherches au niveau cellulaire, décrites par l’auteur, concernent les champs électromagnétiques à extrêmement basses fréquences E.L.F. (inférieures à 1 kHz). Elles ont pour but d’identifier les réponses cellulaires aux champs électromagnétiques à extrêmement basses fréquences (principalement celles qui sont associées aux réseaux électriques 50 / 60 Hz), afin d’établir un niveau-seuil pour de telles interactions, puis d’interpréter et de vérifier les mécanismes d’interactions. Ces études suggèrent comme très probable un site d’interaction au niveau de la membrane cellulaire puisque l’on observe des modifications dans le transport d’ions et dans les événements ligand-récepteur, telle la liaison avec un anticorps, par exemple.
D’autres chercheurs ont signalé que les champs à extrêmement basses fréquences influencent l’activation des enzymes, l’expression des gènes, la synthèse des protéines et la prolifération cellulaire, ces événements étant déclenchés par d’autres, impliquant des transductions de signaux via la membrane cellulaire. Le concept selon lequel les champs électromagnétiques à extrêmement basses fréquences modifieraient d’abord des événements de transduction de signaux de membrane cellulaire précurseurs, et ainsi influenceraient les fonctions à l’intérieur de la cellule via une cascade de transductions de signaux est actuellement l’hypothèse de loin la plus plausible dans la compréhension des effets des champs à extrêmement basses fréquences sur les cellules. L’aboutissement d’une mitogénèse stimulée par l’action des champs à extrêmement basses fréquences, stade final du processus de transduction de signaux, est une augmentation réellement hors normes de la probabilité de mutations génétiques. Le résultat final est le cancer, selon le modèle épigénétique d’Ames de la cancérogenèse. La preuve apportée par l’auteur et son équipe de recherches, quant au fait que les champs électromagnétiques à extrêmement basses fréquences peuvent accélérer la prolifération cellulaire dans certains cancers du sein et peuvent agir comme promoteurs in vitro, concorde avec le schéma de ce mécanisme épigénétique et corrobore le principe de la transduction de signaux en direction de la cancérogénèse.
L’auteur et son équipe ont également réalisé des expérimentations biophysiques afin de déterminer si c’est le champ électrique ou le champ magnétique, ou encore la combinaison entre champ magnétique statique et champs magnétiques alternatifs qui est décisive. Cette question relevant de la métrologie est importante dans la compréhension des mécanismes fondamentaux d’interactions et dans l’élaboration d’une démarche rationnelle en vue de dégager les lignes directrices concernant les seuils de champs électriques et magnétiques à extrêmement basses fréquences à ne pas dépasser. Le poids des preuves expérimentales indique que c’est le champ électrique induit (selon les lois de l’induction de Faraday) durant l’exposition aux champs magnétiques qui explique les effets sur les cellules. Une interaction par champ électrique interposé fournit des éléments intéressants quant à la microdosimétrie au niveau cellulaire. Elle confirme l’hypothèse d’une interaction à la surface de la cellule, étant donné que le champ électrique est censé ne pas traverser la membrane cellulaire.
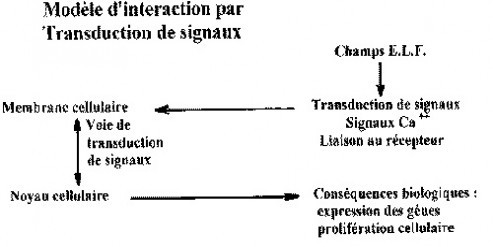
Séquence des événements moléculaires déclenchés par l’interaction des champs électromagnétiques à extrêmement basses fréquences (E.L.F.) avec la membrane cellulaire.
En plus de l’intérêt que présentent les problèmes de métrologie relatifs à l’exposition aux champs E.L.F., il est impérieux de s’intéresser à l’état biologique des cellules cibles. L’auteur et ses collaborateurs, ainsi que d’autres groupes de chercheurs ont montré que les types de cellules, la phase du cycle cellulaire, l’activation cellulaire, l’âge de l’animal (ou de l’humain) donneur, le nombre de passages dans la lignée cellulaire, la présence ou l’absence de facteurs de croissance (agents mitogènes), la température, la densité / empilement durant les expositions sont des points dont il faut tenir compte dans ces interactions entre champs et cellules.
L’auteur relate également des études réalisées par son équipe, sur cellules isolées. Ces études constituent une nouvelle direction de recherche que l’on peut grouper sous la rubrique microbio-électromagnétisme. L’étude de cellules isolées, en faisant appel à la microscopie à images digitalisées est une approche potentielle de la microdosimétrie des champs et de l’observation d’effets biologiques en temps réel. Elle n’est limitée que par le pouvoir de résolution spatiale du microscope, laquelle est d’environ 0,1 micron. L’imagerie digitale en microscopie devrait permettre l’évaluation quantitative des particularités dans l’espace et dans le temps, des interactions des champs électromagnétiques à extrêmement basses fréquences à l’intérieur de cellules vivantes isolées.
Un mécanisme plausible d’interaction : le couplage via la cascade de transduction de signaux.
Toutes les études concernant l’interaction des champs électromagnétiques à extrêmement basses fréquences avec les cellules vivantes aboutissent au concept de l’existence de cascades de transduction de signaux. Il s’agit là d’un mécanisme dont la plausibilité est évidente. R.P. Liburdy et son équipe ont mené plusieurs expérimentations résumées ci-après. Réalisées selon des méthodologies différentes, elles concourent à corroborer ce concept. Elles montrent les réponses cellulaires aux champs électromagnétiques à extrêmement basses fréquences, à partir des phénomènes au niveau de la membrane cellulaire, tels les flux d’ions calcium, jusqu’aux effets indirects comme l’activation des gènes, la prolifération cellulaire et en fin de parcours, la cancérogénèse.
Les champs électromagnétiques à extrêmement basses fréquences influencent la cascade de transduction de signaux au niveau de la membrane cellulaire et déclenchent la modification de l’influx des ions calcium et/ou des liaisons avec les récepteurs. Les événements subséquents comme l’expression des gènes et la synthèse des protéines qui aboutiront à la prolifération cellulaire sont influencés à terme, dans la mesure où les modifications initiales des signaux du calcium sont répercutées sur la cascade de transduction de signaux. Plusieurs publications traitant des interactions des champs électromagnétiques à extrêmement basses fréquences (p.ex. 50 / 60 Hz) avec les systèmes cellulaires et les transductions de signaux vont dans le même sens.
La membrane cellulaire, site initial de couplage.
La transduction de signaux commence à la surface de la cellule et est à la base de la communication de la cellule avec son environnement. Il s’agit d’un processus général dans lequel une molécule de ligand s’accroche à son site récepteur sur la surface cellulaire et déclenche une cascade d’événements biochimiques dans la membrane cellulaire, lesquels initient une activation enzymatique, une activation de gènes, une synthèse de protéines et finalement la mitogénèse et la prolifération cellulaire. La transduction de signaux est nécessaire aux fonctions cellulaires, à la croissance et à la différentiation. Deux systèmes majeurs de transmission de signaux dans la membrane cellulaire impliquent la dissociation du récepteur tyrosyle-kinase et du récepteur phospholipide. La protéine réceptrice de l’insuline, par exemple, est une tyrosyle-kinase qui est activée par la liaison avec l’insuline. Dans le second système, qui est largement présent et se retrouve dans toutes les cellules dépendant du calcium, un ligand se lie à son récepteur et déclenche la dissociation des phospholipides dans la membrane cellulaire, en aboutissant ainsi à la production de « messagers secondaires » qui contrôlent une myriade de mécanismes métaboliques, de la croissance cellulaire à la différentiation. Beaucoup de récepteurs différents participent à ce processus de transduction de signaux. Par exemple, lorsque la concanavaline-A (Con-A) ou d’autres agents mitogènes se lient aux récepteurs des lymphocytes-T, ceci déclenche une dissociation des phospholipides avec production d’inositol(1,4,5)triphosphate, lequel à son tour augmente le taux de calcum intracellulaire. Il est important de noter que l’augmentation de la concentration en ions calcium liés à des protéines comme la calmoduline et des kinases maintiennent la cascade de transduction de signaux dans la cellule, ce qui aboutit finalement à la synthèse d’ADN, d’ARN et de protéines, à la prolifération cellulaire et à un processus de multiplication clonale de lymphocytes-T.
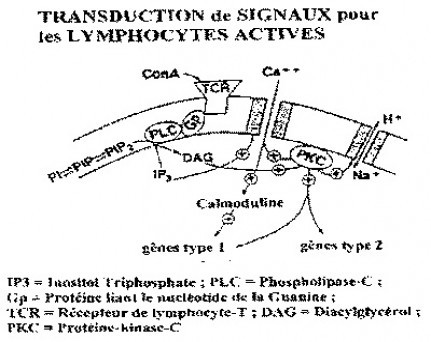
La figure ci-dessus montre le schéma de la cascade de transduction de signaux dans les lymphocytes activés. Ce schéma s’applique à des transductions de signaux dans les cellules, par l’intermédiaire de récepteurs.
R.P. Liburdy et son équipe ont observé l’influx calcique de deux manières:
a. en utilisant du calcium-45 (45Ca) (radio-actif) afin de suivre l’influx,
b. en utilisant un indicateur de fluorescence, le FURA-2AM pour observer en temps réel les modifications du calcium libre intracellulaire.
a. Etude de l’influx calcique avec du 45Ca en absence ou en présence de concanavaline-A.
Le calcium extracellulaire pénètre dans la cellule via un canal qui s’ouvre lorsque la concanavaline-A (Con-A) se lie au récepteur des lymphocytes-T, à la surface des cellules. Le premier événement est la liaison du récepteur de la Con-A avec le domaine extracellulaire du récepteur du lymphocyte-T, lequel active une tyrosine-kinase dans le milieu cytoplasmique. Ceci se produit instantanément et représente le premier stade de couplage dans la cascade de transduction de signaux. La phosphorylation de la tyrosine du complexe protéine-G conduit à l’activation de la phospholipase-C, laquelle dissocie le phosphoinositol dans la membrane cellulaire, pour produire l’inositol(1,4,5)triphosphate et le diacylglycérol. L’inositol(1,4,5)triphosphate ouvre les canaux calciques et agit également comme un transporteur de calcium endogène pour libérer le calcium de son lieu de mise en réserve dans le réticulum endoplasmique et dans les mitochondries. Le diacylglycérol active la protéine-kinase-C qui régule entre autres le transport d’ions hydrogène et le pH intracellulaire.
Ainsi, après liaison avec le récepteur, il apparaît des augmentations quasi instantanées du calcium et du pH intracellulaires. Ces deux paramètres ont été suivis en temps réel dans des lymphocytes exposés à des champs électromagnétiques à extrêmement basses fréquences. Finalement les gènes de transduction de signaux comme le c-myc sont activés via l’action de la calmoduline ou de la protéine-kinase-C. La cellule s’engage ainsi à terme dans la mitogénèse.
Les interactions entre champs électromagnétiques à extrêmement basses fréquences et la cascade de transduction de signaux constituent une formidable amplification. La propagation des signaux implique plusieurs étapes qui vont amplifier l’effet de la liaison première à la surface de la cellule. Par exemple, la liaison d’une molécule se liant à un récepteur à la surface de la cellule, aboutit à l’activation de multiples protéines à effet transducteur ou à l’influx d’un grand nombre d’ions calcium, lesquels vont activer des molécules d’enzymes intracellulaires.
R.P. Liburdy et ses collaborateurs ont établi la preuve de ces mécanismes amplifiés par les champs électromagnétiques au moyen de calcium radio-actif 45Ca sur des lymphocytes de thymus de rats en absence ou en présence de concanavaline-A (activateur). Des cellules faiblement activées par la Con-A accusaient une réponse maximale au champ électromagnétique.
Les lymphocytes-T d’animaux âgés présentaient une activation minimale en présence de Con-A et une augmentation très importante de l’influx calcique suite à l’exposition aux champs électromagnétiques, par rapport aux lymphocytes-T de sujets jeunes.
L’état biologique de l’animal porteur est décisif dans l’initiation de la réponse des lymphocytes aux champs magnétiques. La réduction de la réponse mitogénique avec l’âge concorde avec les données de la littérature courante en immunologie.
c. Etude de l’influx calcique avec indicateur de fluorescence FURA-2AM.
Cette approche a permis aux auteurs d’observer les effets de champs électromagnétiques en temps réel. Le FURA-2AM est un colorant fluorescent sensible au calcium (1), que l’on fixe sur les lymphocytes-T.
Lorsque l’agent mitogène Con-A a été mis en présence des lymphocytes-T, à des concentrations suboptimales (1 microgramme / ml) durant l’exposition aux champs électriques 60 Hz, les niveaux de calcium intracellulaire augmentaient immédiatement pour atteindre un plateau environ 400 secondes plus tard. Ceci était significativement plus élevé que pour les cellules traitées à la Con-A, mais non exposées aux champs électriques.
Ces expériences ont été répétées neuf fois, en utilisant diverses préparations cellulaires.
Ces résultats confirment ceux obtenus avec le 45Ca
Les études par fluorescence en temps réel permettent d’identifier le site d’interaction. Il est bien connu que l’augmentation du signal du calcium dans le calcium intracellulaire pendant la transduction de signaux est due à la libération de calcium par les mitochondries et par le réticulum endoplasmique.
Grâce à ces travaux, les auteurs ont pu démontrer que la membrane cellulaire et spécifiquement l’influx calcique sont directement impliqués dans l’interaction des champs électromagnétiques à extrêmement basses fréquences.
Activation des gènes
Les résultats des recherches exposés ci-avant indiquent que les taux d’ions calcium intracellulaires et le pH intracellulaire sont tous deux exaltés durant la transduction de signaux en présence de champs électromagnétiques à extrêmement basses fréquences.
Les auteurs ont suivi deux polypeptides : le c-MYC et le m-ARN car l’oncogène c-MYC fait partie d’une collection de messagers cellulaires communément considérés comme des « gènes à réponse immédiate », étant donné que leur expression est activée par une quantité de stimuli mitogéniques, depuis l’état de repos de la cellule jusqu’au stade de multiplication.
Les produits protéiniques de gènes à réponse immédiate comme le c-MYC sont considérés comme destinés à faciliter la progression de la cellule à travers le cycle cellulaire et à synthétiser l’ADN en phase S. Les polypeptides c-MYC jouent des rôles dans le contrôle, pendant la transcription et après la transcription d’autres gènes cellulaires et dans la réplication de l’ADN. Des preuves solides existent quant au fait qu’ils accomplissent leur fonction médiatrice comme des protéines de liaisons d’ADN à sites spécifiques. Les cellules maintiennent le c-MYC dans un cadre très restreint de régulation.
R.P. Liburdy et son équipe ont expérimenté sur des lymphocytes de thymus de rats. Les échantillons de cellules étaient prélevés et répartis en deux parties puis l’influx calcique ainsi que le c-MYC et le m-ARN ont été évalués.
L’influx calcique et la transcription du c-MYC ainsi que du m-ARN sont plus élevés dans la population de lymphocytes de thymus de rat activés par mitogène (Con-A) et exposés à un champ magnétique 60 Hz que dans la même population de lymphocytes activés par mitogène et non exposés à un champ magnétique 60 Hz.
Ces expérimentations ont fait appel à des techniques de pointe avec caméras CCD et ont sélectionné des animaux donneurs selon trois tranches d’âges afin de comparer les résultats.
Les résultats indiquent de façon indiscutable une augmentation de 4 fois la concentration en c-MYC et en m-ARN lors de l’exposition aux champs magnétiques 60 Hz. Ils apportent la preuve que les effets des champs magnétiques à extrêmement basses fréquences sur les deux processus de transduction de signaux (influx calcique et augmentation du taux de c-MYC et de m-ARN) sont liés. En se basant sur le rôle du calcium dans la cascade de transduction de signaux, on apporte une preuve réelle de l’existence d’un mécanisme d’interaction dans lequel les champs électromagnétiques à extrêmement basses fréquences déclenchent l’influx calcique au niveau de la membrane cellulaire et ceci conduit à des modifications subséquentes dans les événements des schémas de transduction de signaux. Ce modèle d’interaction par transduction de signaux indique comment les effets des champs à extrêmement basses fréquences peuvent perturber d’autres événements cellulaires au cours de la cascade et en particulier dans la transcription des gènes.
D’autres laboratoires de recherches ont étudié les effets des champs électromagnétiques sur le c-MYC et sur le m-ARN sur d’autres lignées de cellules et ont abouti aux mêmes conclusions.
Prolifération cellulaire
Le point terminal dans le processus de transduction de signaux est la prolifération cellulaire, qui aboutit à la mitogénèse. Etant donné que la prolifération est le point ultime du schéma de transduction de signaux, il est important que les études soient conduites en vue d’évaluer les effets des champs électromagnétiques à extrêmement basses fréquences sur la prolifération et la croissance, et en particulier sur les lignées de cellules cancéreuses. C’est ce que R.P. Liburdy et ses collaborateurs ont exploré dans un cas précis de cellules de cancer du sein humain. Il s’agit d’une question importante, étant donné que les champs électromagnétiques à extrêmement basses fréquences ont été soupçonnés d’être un facteur significatif de risque épidémiologique de cancer du sein humain.
Les auteurs ont découvert que la croissance des cellules de cancer du sein humain est modifiée par un champ magnétique alternatif 60 Hz. Dans ces études, un agent oncostatique naturel, la mélatonine, a été utilisé pour supprimer la croissance des cellules de cancer du sein. Cette faculté de la mélatonine a été utilisée pour explorer l’effet de l’exposition au champ magnétique sur les cellules cancéreuses.
R.P. Liburdy et son équipe ont choisi une lignée de cancer du sein humain particulière: la lignée MCF-7. Ils ont tout d’abord vérifié que la croissance des cellules MCF-7 était bien supprimée par la mélatonine, en présence d’un champ magnétique alternatif 60 Hz de 2 ou de 12 milligauss. La mélatonine est une hormone et un inhibiteur naturel de croissance des cellules du cancer du sein positives aux oestrogènes (MCF-7). La mélatonine est intéressante car :
- elle présente une activité oncostatique naturelle vis-à-vis des cellules de cancer du sein,
- la libération de mélatonine dans le flux sanguin d’animaux est décrite dans une abondante littérature, comme étant inhibée par les champs magnétiques alternatifs,
- les expositions aux champs magnétiques 60 Hz sont soupçonnés être un facteur de risque pour le cancer du sein humain.
Les expériences sur cultures de cellules in vitro ont en général négligé le fait que tous les incubateurs disponibles dans le commerce produisent des champs magnétiques et électriques dus aux systèmes de chauffage et aux échanges gazeux à programmation électronique adaptés sur les incubateurs. Des variations considérables existent, selon les types d’incubateurs existant sur le marché. Il existe des champs magnétiques fluctuant, durant l’action momentanée des bobines de commande des vannes de gaz des incubateurs et durant les impulsions passagères de chauffage du système thermostatique à eau maintenant la température dans l’enceinte de l’incubateur. De plus, quelques incubateurs ont des panneaux de portes chauffés électriquement. Tous ces champs ont une fréquence de 60 Hz (réseau électrique) et / ou des composantes à extrêmement basses fréquences. Leurs profils varient significativement au cours du temps, selon le nombre de fois où les portes sont ouvertes. Un autre problème significatif réside dans le fait que ces champs alternatifs peuvent rayonner selon des configurations spatiales variables au sein de l’incubateur. La plupart, sinon tous les incubateurs ont leur équipement de programmation électronique monté sur le plan supérieur de l’incubateur. Les cultures de cellules placées sur les plateaux supérieurs sont exposées à des champs plus importants que celles qui sont placées sur les plateaux inférieurs. Les auteurs ont étudié un système permettant d’exposer les cultures cellulaires à des champs magnétiques très uniformes tout en conservant les dispositions internes d’incubateurs disponibles dans le commerce habituel.
Les incubateurs utilisés par R.P. Liburdy ont été réalisés avec un système de solénoïdes à enroulements inverses et l’enceinte a été délimitée par une carcasse à parois en mu-métal (blindage magnétique), afin de pouvoir à tout instant contrôler le champ magnétique alternatif intérieur en intensité et en configuration spatiale.
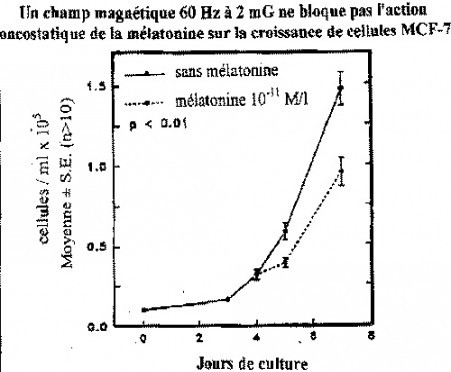
Cette étude a débuté par une vérification de l’hypothèse selon laquelle le champ 60 Hz bloquerait l’activité oncostatique de la mélatonine sur la multiplication des cellules du cancer du sein MCF-7. La mélatonine inhibe la prolifération des cellules MCF-7 lorsqu’elle est présente dans le milieu de la culture cellulaire à des concentrations correspondant à la plage physiologique de 10-9 à 10-11 môle par litre. Les courbes de croissance des cellules MCF-7 en l’absence et en la présence de mélatonine 10-11 M/l sont représentées sur le graphique ci-après (graphique 1).
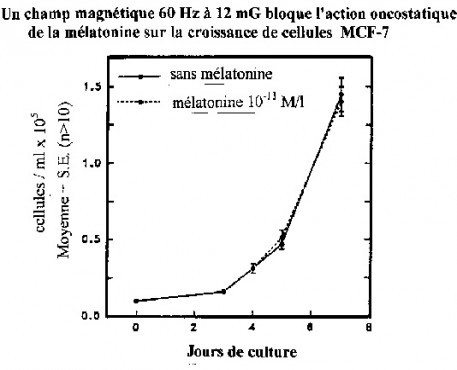
Simultanément à des expositions à des champs magnétiques 60 Hz, sous une intensité de 2 milligauss, les auteurs ont réalisé des expositions comparées à 12 milligauss (graphique 2) dans un incubateur identique. Ce niveau de champ magnétique représente un niveau d’environnement qui est celui ou qui est proche de celui que l’on peut rencontrer à proximité de lignes à haute tension et de réseaux électriques de distribution.
Note du traducteur : Dans la plupart des habitations dont l’installation électrique a été réalisée avec soin et discernement, les champs magnétiques alternatifs ne dépassent jamais 2 mG (sauf en cas de chauffage électrique par le sol ou par le plafond ou en cas de présence de lignes déséquilibrées de réseau 380/220 V extérieur à l’habitation, enterrées ou non).
Graphique 1 : Activité oncostatique de la mélatonine sur la croissance des cellules MCF-7 dans un champ magnétique 60 Hz de 2 mG. La mélatonine à la concentration de 10-11 M/l inhibe de 30 % la croissance des cellules cancéreuses le septième jour, en présence d’un champ 60 Hz ambiant de 2 mG
Graphique 2 : Activité oncostatique de la mélatonine sur la croissance de cellules cancéreuses MCF-7 dans un champ magnétique 60 Hz de 12 mG. Le champ magnétique 60 Hz à 2 mG bloque complètement l’activité oncostatique naturelle de la mélatonine.
Ces résultats indiquent qu’un seuil dose-réponse existe apparemment entre 2 milligauss et 12 milligauss.
Ces découvertes concernant les cellules cancéreuses MCF-7 indiquent :
- que cet effet in vitro est un niveau cellulaire de réponse aux champs magnétiques, impliquant la prolifération et la croissance cellulaire,
- que cet effet implique une interaction qui nécessite la présence de mélatonine, laquelle est un agent oncostatique naturel,
- qu’un seuil dose-réponse semble exister entre 2 mG et 12 mG.
Ceci représente une première preuve de l’existence d’un niveau cellulaire de réponse aux champs magnétiques à extrêmement basses fréquences, dépendant de la mélatonine et en relation avec le cancer du sein humain.
Plusieurs modèles ont été proposés pour expliquer la relation entre l’exposition aux champs magnétiques alternatifs à extrêmement basses fréquences et l’apparition de cancer du sein. Ces modèles suggèrent que l’aspect le plus important de cette relation est une diminution marquée de la sécrétion de mélatonine en réponse à une exposition in vivo aux champs magnétiques, concomitante avec une augmentation de la production de prolactine et d’œstrogène. Cette dernière est supposée augmenter la croissance de cellules épithéliales de sein, prédisposées. Par contre, les résultats obtenus dans les laboratoires de l’équipe de R.P. Liburdy traitent d’expositions in vitro de cellules de cancer du sein. Donc ils impliquent des événements cellulaires sous-jacents. Mais il ne faut pas négliger le fait d’une action à distance d’inhibition in vivo de la sécrétion de mélatonine par la glande pinéale (épiphyse). Les découvertes de l’équipe de R.P. Liburdy montrent la possibilité d’existence d’une interaction directe au niveau cellulaire, entre champs magnétiques à extrêmement basses fréquences (50 / 60 Hz), cellules de cancer du sein et mélatonine. Ceci signifie qu’en plus de l’effet d’un champ magnétique sur la libération de mélatonine dans le système sanguin, il peut également exister un effet direct du champ magnétique à extrêmement basse fréquence sur la fonction de la mélatonine au niveau de cellules cibles, par exemple des tissus de sein humain cancéreux et leur prolifération.
Etudes concernant les mesures de champs au niveau des cellules
Une question importante se pose concernant la composant de champ électromagnétique suscitant l’effet biologique : champ électrique ou champ magnétique. Il faut savoir que les deux champs sont simultanément induits par un champ magnétique.
L’importance d’une distinction entre les deux effets est double:
- la connaissance des mesures de niveaux d’exposition est essentielle pour élaborer des lignes directrices d’exposition. L’importance de celle-ci devient claire lorsque des différences entre la dosimétrie des champs électriques et des champs magnétiques dans les tissus et dans l’air sont constatées. Les champs magnétiques pénètrent la matière biologique de façon quasi uniforme, tandis que les champs électriques sont significativement atténués. Cette atténuation est hétérogène et dépend de la conductivité spécifique des tissus, laquelle peut varier considérablement (ce qui écarte toute notion de calcul théorique de courant induit). Ces facteurs rendent complexes les évaluation dosimétriques dans l’espace. La connaissance de la mesure du niveau des composantes de champs électrique et magnétique correspondant à des réponses biologiques simplifierait déjà l’analyse.
- l’obtention d’informations concernant les mécanismes d’interaction. La connaissance de la (des) composante(s) de champ responsable(s) de l’effet biologique observé permettra de mettre en formules vérifiables les mécanismes de couplage des champs
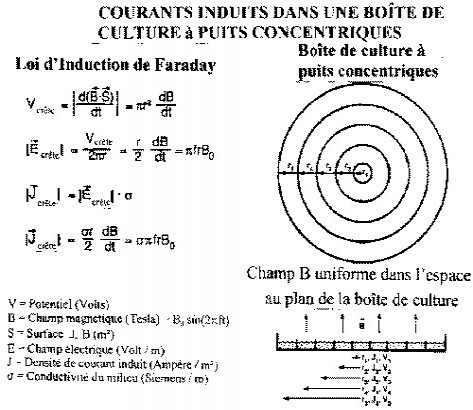
La loi de l’induction de Faraday indique la relation quantitative qu’un champ magnétique alternatif a avec un champ électrique alternatif qu’il induit. A partir de cette loi, on peut concevoir des expérimentations sur cellules pour vérifier directement si un champ magnétique appliqué ou si le champ électrique induit est le paramètre actif.
Pour ce faire, R.P. Liburdy et ses collaborateurs ont utilisé des boîtes de Pétri à puits annulaires concentriques multiples (voir figure ci dessous), dont certaines étaient munies de cuvettes interrompant l’anneau creux. Ceci permettait de travailler sous champ magnétique seul ou avec et sans champ électrique induit. Les facteurs d’échelonnement des rayons des puits étaient 1 : 3 : 5.
La question posée était donc : pendant une exposition au champ magnétique, l’échelle de l’effet biologique variait-elle avec le champ électrique induit ?
L’étude sur la capture du calcium a montré que le champ électrique induit est le paramètre décisif.
Les effets physiques dominants, associés à un champ électrique interagissant avec la surface cellulaire impliquent la production de courants de surface, le mouvement ou le déplacement de fragments moléculaires chargés sur le feuillet externe de la double couche membranaire et de subtiles modifications structurelles comme des pertes de protéines ou des altérations de conformations lipides / protéines. Il ne faut donc pas s’attendre à ce qu’une interaction utilisant un champ électrique comme médiateur, se produisant à la surface cellulaire, influence directement des structures ou des composants internes de la cellule, comme l’ADN, l’ARN et des protéines internes. C’est une raison pour laquelle le concept de transduction de signaux est une voie logique permettant d’interpréter l’action d’un champ à la surface cellulaire, impliquant le calcium où la conformation récepteur-ligand peut induire des modifications ultérieures de l’ADN, de l’ARN et de la synthèse des protéines.
Microbio-électromagnétisme
Les auteurs ont mis au point une technique permettant d’exposer des cellule isolées de lymphocytes de thymus de rat à diverses conditions de champs, en utilisant une caméra spéciale (CCD) et une digitalisation de l’image microscopique, en faisant appel à un indicateur de fluorescence FURA-2AM. Ils ont pu ainsi montrer les liaisons de la concanavaline-A à la surface cellulaire et les modifications conséquentes de la concentration en calcium intracellulaire. Des études futures basées sur cette technique permettront selon les auteurs d’obtenir des résultats précis concernant les mécanismes d’action.
(1) Le FURA-2AM est repris au catalogue SIGMA sous le n° F-0888